큰사진보기
|
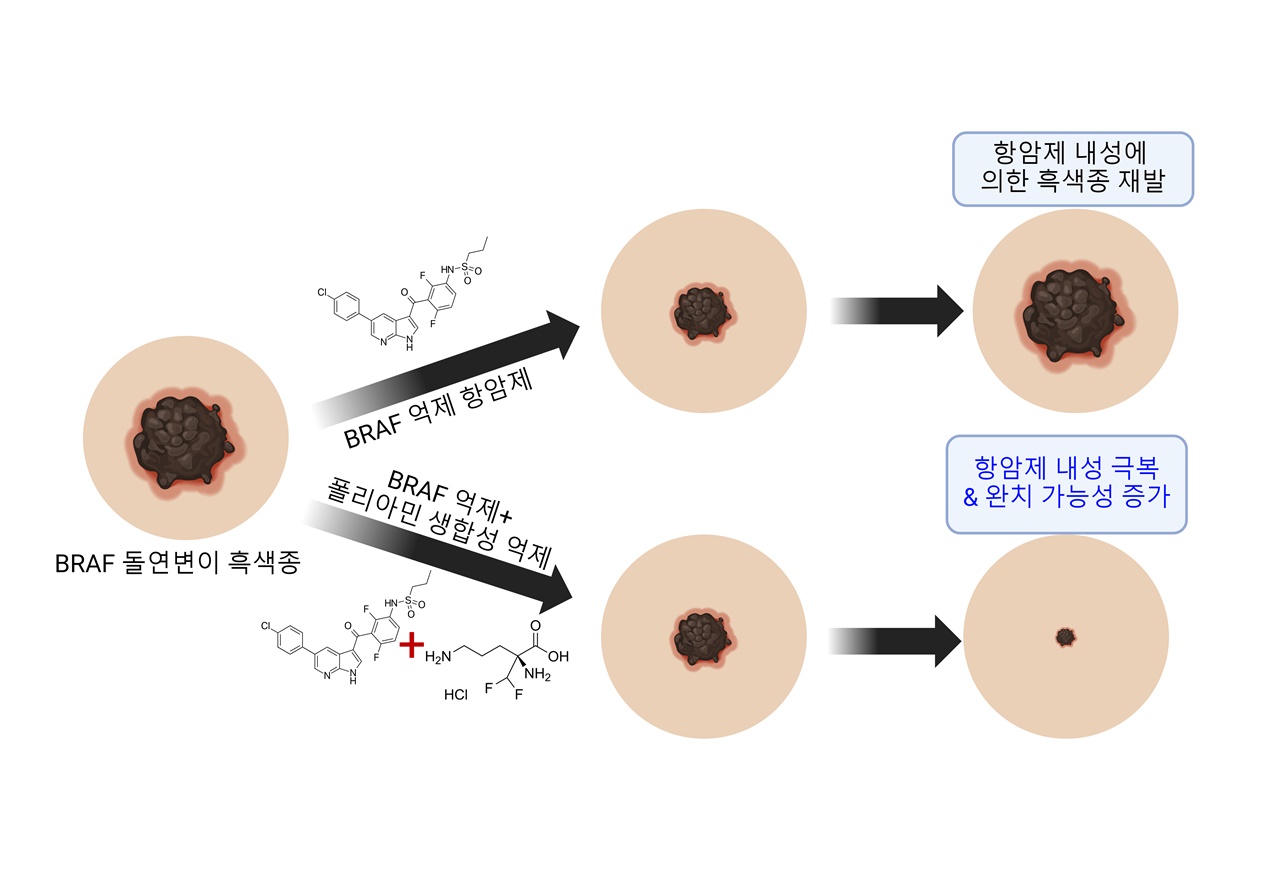
| ▲ 폴리아민 생합성 억제를 통한 BRAF 억제 항암제 내성 극복 (위) 흑색종은 BRAF 억제 항암제 투여에도 항암제 내성이 발생하여 암이 재발함. (아래) 폴리아민 생합성 억제와 BRAF 억제 항암제를 조합하면 암의 재발을 막고 완치 가능성이 증가할 수 있음. |
| ⓒ 한국과학기술연구원 제공 | 관련사진보기 |
피부 속 색소를 만들어 주는 멜라닌 세포가 일으키는 암인 '흑색종'은 전이나 재발이 쉽게 발생해 피부암 중 가장 치명적인 암으로 알려져 있다.
특히 현재 임상에서는 BRAF(비라프)라는 발암 유전자를 억제하는 표적 항암제로 흑색종을 치료하고 있지만, 흑생종의 경우 약물에 대한 내성이 빠르게 발생해 치료 효과가 높지 않다는 한계를 극복하는 연구 결과를 국내 연구진이 내놨다.
한국과학기술연구원(KIST, 원장 오상록)은 11일 "KIST 의약소재연구센터 김택훈 박사 연구팀이 흑색종이 BRAF 억제 항암제에 대한 내성을 가지게 되는 핵심 기전을 새롭게 규명했다"면서 "내성 발생을 억제할 수 있는 새로운 항암제 개발 전략을 제시했다"고 밝혔다.
전 세계적인 고령화 추세로 인해 흑색종 환자가 빠르게 늘어 2040년에는 매년 세계에서 약 10만 명이 흑색종으로 사망할 것으로 보고되고 있는 가운데 이번에 항암제 내성이 생긴 흑색종의 핵심 기전 규명으로 치료 효과가 높은 신규 항암제 개발에 기대가 커지고 있다.
참고로, 'BRAF'란 세린/트레오닌 단백질 키나아제로, 인간의 세포 성장과 분열을 조절하는 신호 전달 경로에서 중요한 역할을 하는 단백질이라고 한다.
큰사진보기
|
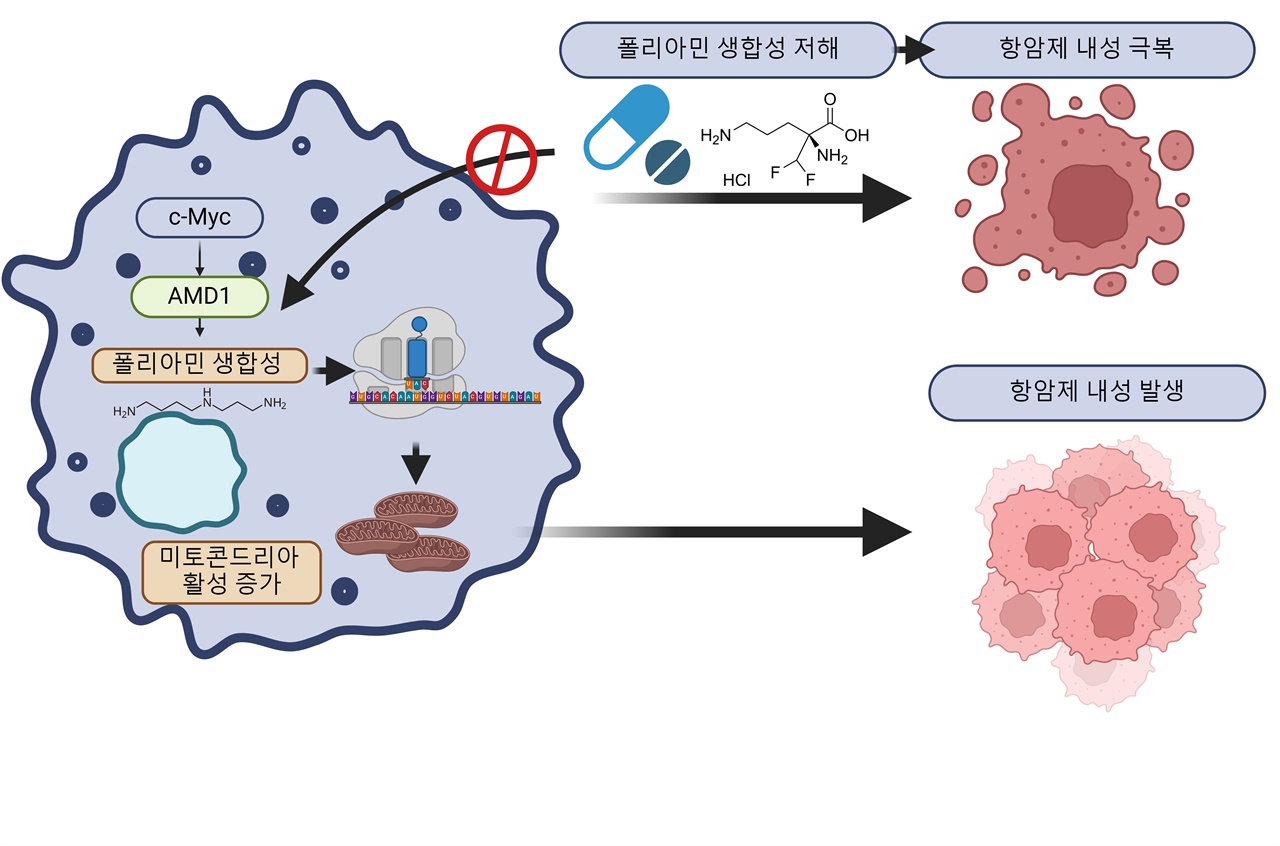
| ▲ BRAF 억제 항암제 내성 발생 기전 BRAF 억제 항암제 내성 흑색종은 c-Myc 발암유전자 활성에 의해 AMD1을 비롯한 폴리아민 생합성이 증가하여 결국 미토콘드리아의 활성이 증가하여 항암제 내성을 유도함. 본 연구에서는 폴리아민 생합성 저해를 통해 이 기전을 막음으로써 항암제 내성을 극복하였음. |
| ⓒ 한국과학기술연구원 제공 | 관련사진보기 |
우선, KIST 연구팀은 BRAF 항암제에 내성을 지닌 세포주 모델을 이용해 'AMD1 유전자'의 활성이 항암제 내성을 가지는 데 중요한 역할을 하고 있음을 발견했다.
연구팀에 따르면, 'AMD1'은 S-adenosylmethionine decarboxylase1의 약자로, 세포 내에 다량 존재하는 S-adenosylmethionine을 탈카복시화함으로써 폴리아민(polyamine) 생합성에 꼭 필요한 decarboxylated S-adenosylmethionine을 만들어내는 효소라고 한다. 폴리아민은 푸트레신, 스퍼미딘, 스퍼민과 같이 아미노기(amine)를 두 개 이상 가진 세포 내 대사물질로 핵산의 안정화, 핵산, 단백질의 합성 촉진 등 세포 성장에 다양하게 활용되는 물질이다.
연구팀은 "AMD1 유전자는 세포의 성장과 증식을 촉진하는 폴리아민(polyamine) 생합성에 필수적인 역할을 하는데, 일반적으로 암세포에서 폴리아민이 더 높은 수준으로 나타난다"면서 "실험을 통해 이 유전자의 활성을 조절한 결과, 폴리아민 생합성을 억제하면 BRAF 항암제에 대한 내성도 낮아져 흑색종이 사멸됨을 확인했다"고 설명했다.
이를 바탕으로 연구팀은 항암제 내성 흑색종에서 발암 유전자인 c-Myc이 폴리아민 생합성의 증가를 유발하고 있음을 밝혀냈다.
이렇게 증가된 폴리아민이 미토콘드리아 단백질의 양을 증가시켜 미토콘드리아 활성을 높이며, 이로 인해 항암제에 내성을 지닌 암세포의 증식으로 이어지는 과정이 흑색종 항암제 내성 발생 핵심 기전임을 규명했다.
큰사진보기
|
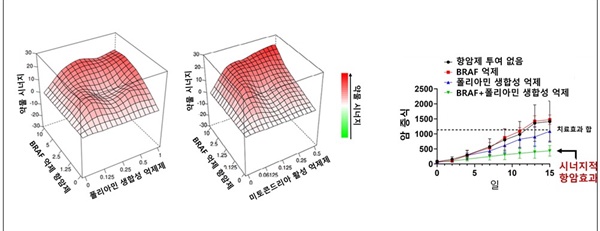
| ▲ 항암제 효능의 시너지적 효과 (왼쪽) BRAF 억제 항암제와 폴리아민 생합성 억제제 혹은 미토콘드리아 활성 억제제의 시너지적인 세포 사멸 (오른쪽) BRAF 억제 항암제와 폴리아민 생합성 억제제 조합에 의한 시너지적인 항암효과 확인 |
| ⓒ 한국과학기술연구원 제공 | 관련사진보기 |
KIST는 이번 연구에 대해 "기존에 거의 알려지지 않았던 폴리아민 생합성이 BRAF 항암제 내성 유발의 원인임을 밝힌 세계 최초의 연구"라며 "나아가 연구팀이 BRAF 항암제에 대한 내성을 극복하기 위해 내성 기전의 각 단계를 억제하는 항암제 개발 전략을 제시했다"고 강조했다.
이번 연구를 통해 항암제 내성이 빈번하게 발생해 완치가 어려웠던 흑색종을 치료할 수 있는 폴리아민 대사 조절 기반의 신규 항암제 개발이 가능해졌다는 평가다. 이를 통해 2028년 10억 달러 규모로 전망되는 BRAF 억제 항암제 시장에 적용가능한 선도 기술을 확보할 것으로 기대하고 있다.
김택훈 KIST 박사는 "가장 치명적인 피부암인 흑색종의 항암제 내성 발생의 핵심 기전을 규명했다"면서 "대사항암제 개발을 위해 BRAF 돌연변이가 자주 나타나는 대장암, 갑상선암 등에서 폴리아민 대사 조절을 통한 항암 효과 검증을 수행할 예정"이라고 전했다.
한편, 이번 연구는 과학기술정보통신부(장관 유상임)의 지원을 받아 KIST 주요사업 및 중견연구자지원사업, 바이오의료기술개발사업, 국가과학기술연구회 선행융합연구사업 및 창의형 융합연구사업 등으로 수행됐다. 이번 연구 성과는 국제 학술지 (IF 27.7, JCR 분야 상위 1.1%) 최신 호에 게재됐다.